le risque de décès et d'hospitalisation pour insuffisance cardiaque dans une certaine mesure.Cependant, les patients présentent un risque élevé d'événements récurrents d'aggravation de l'insuffisance cardiaque, la mortalité reste autour de 25 % et le pronostic reste sombre.Par conséquent, il existe toujours un besoin urgent de nouveaux agents thérapeutiques dans le traitement de l'HFrEF, et le Vericiguat, un nouveau stimulateur soluble de la guanylate cyclase (sGC), a été étudié dans l'étude VICTORIA pour évaluer si le Vericiguat pouvait améliorer le pronostic des patients atteints d'HFrEF.L'étude est une étude de résultats cliniques de phase III multicentrique, randomisée, en groupes parallèles, contrôlée par placebo, en double aveugle, axée sur les événements.Menée sous les auspices du Centre VIGOR au Canada en collaboration avec le Duke Clinical Research Institute, 616 centres dans 42 pays et régions, dont l'Europe, le Japon, la Chine et les États-Unis, ont participé à l'étude.Notre service de cardiologie a été honoré d'y participer.Un total de 5 050 patients atteints d'insuffisance cardiaque chronique âgés de ≥ 18 ans, classe II-IV de la NYHA, FE < 45 %, avec des taux élevés de peptide natriurétique (NT-proBNP) dans les 30 jours précédant la randomisation, et qui avaient été hospitalisés pour insuffisance cardiaque dans les 6 mois précédant la randomisation ou ayant reçu des diurétiques administrés par voie intraveineuse pour l'insuffisance cardiaque dans les 3 mois précédant la randomisation ont été inscrits à l'étude, tous recevant ESC, AHA/ACC et les directives nationales/régionales spécifiques ont recommandé la norme de soins.Les patients ont été randomisés selon un rapport 1:1 en deux groupes et ont reçu du Vericiguat (n = 2526) et un placebo (n = 2524) en plus du traitement standard, respectivement.
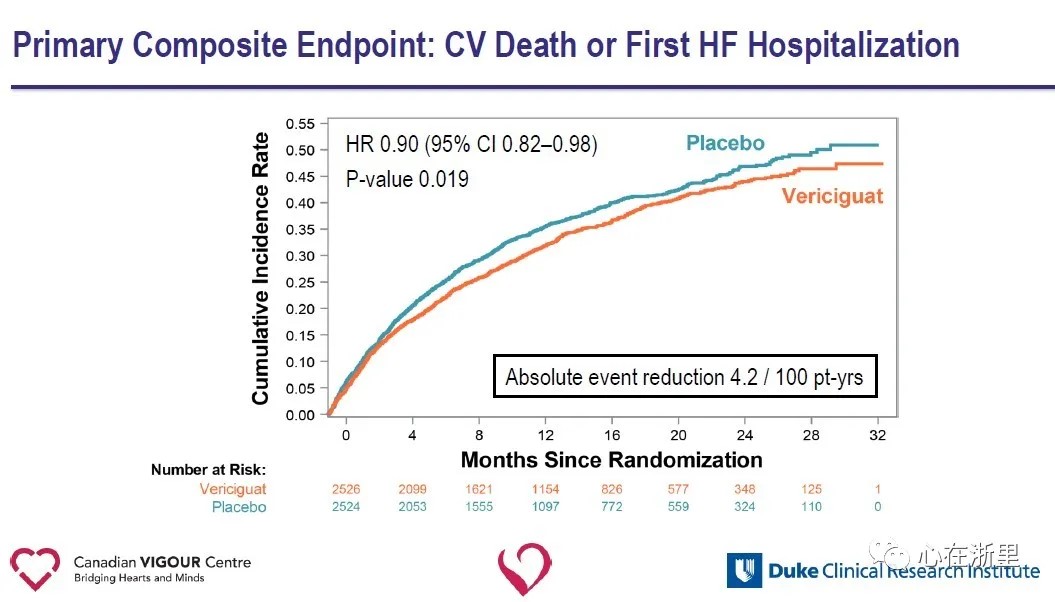
Le critère d'évaluation principal de l'étude était le critère d'évaluation composite du décès cardiovasculaire ou de la première hospitalisation pour insuffisance cardiaque ;les critères d'évaluation secondaires comprenaient les composantes du critère d'évaluation principal, les premières hospitalisations pour insuffisance cardiaque et les suivantes (premiers événements et événements récurrents), le critère d'évaluation composite du décès toutes causes confondues ou de l'hospitalisation pour insuffisance cardiaque et le décès toutes causes confondues.Lors d'un suivi médian de 10,8 mois, il y a eu une réduction relative de 10 % du critère principal de décès cardiovasculaire ou de première hospitalisation pour insuffisance cardiaque dans le groupe Vericiguat par rapport au groupe placebo.
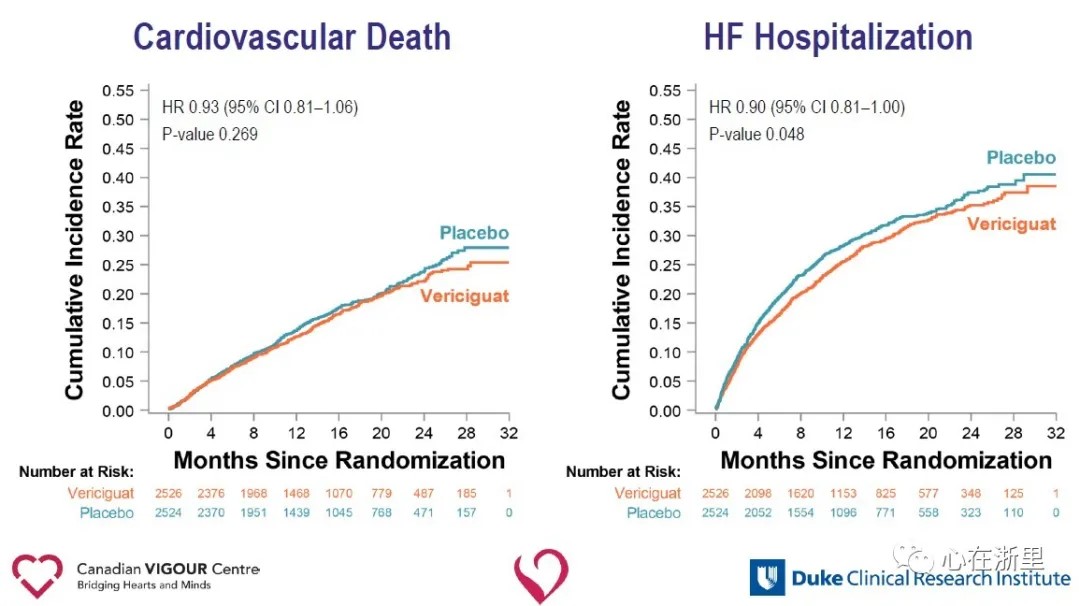
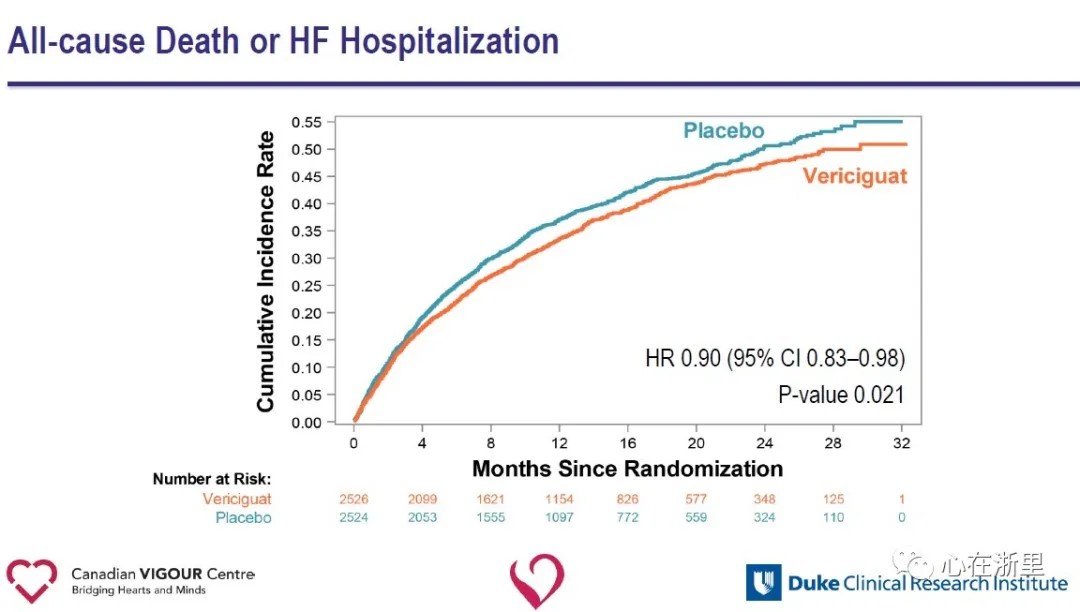
L'analyse des critères secondaires a montré une réduction significative des hospitalisations pour insuffisance cardiaque (HR 0,90) et une réduction significative du critère composite de décès toutes causes confondues ou d'hospitalisation pour insuffisance cardiaque (HR 0,90) dans le groupe Vericiguat par rapport au groupe placebo.
Les résultats de l'étude suggèrent que l'ajout de Vericiguat au traitement standard de l'insuffisance cardiaque réduit de manière significative la survenue récente d'événements d'aggravation de l'insuffisance cardiaque et réduit le risque du critère composite de décès cardiovasculaire ou d'hospitalisation pour insuffisance cardiaque chez les patients atteints d'HFrEF.La capacité de Vericiguat à réduire le risque du critère composite de décès cardiovasculaire ou d'hospitalisation pour insuffisance cardiaque chez les patients atteints d'insuffisance cardiaque à haut risque offre une nouvelle voie thérapeutique pour l'insuffisance cardiaque et ouvre de nouvelles voies pour l'exploration future des maladies cardiovasculaires.Vericiguat n'est pas actuellement approuvé pour la commercialisation.L'innocuité, l'efficacité et la rentabilité du médicament doivent encore être testées plus avant sur le marché.
Heure de publication : 08 février 2022